|
环境温度挑战会触发大脑协调自主神经和行为反应,欧博以维持最佳体温。然而,目前尚不清楚温度信息是如何在大脑中精确存储和提取的,也不清楚它是如何转化为生理反应的。 基于此,2025年4月23日,都柏林圣三一大学Tomás J. Ryan研究团队在Nature杂志发表了“Cold memories control whole-body thermoregulatory responses”揭示了寒冷记忆主导全身的体温调节反应。
作者通过结合体温调节的经典条件反射(巴甫洛夫条件反射)、记忆痕迹标记技术、光遗传学和化学遗传学让小鼠将某一特定环境与特定温度联系起来。发现如果小鼠被重新置于之前经历过4°C寒冷挑战的环境中,无论实际环境温度如何,它们都会提高代谢率。此外,作者还发现当小鼠暴露在寒冷环境中时,下丘脑活动增强,并且在回忆寒冷记忆时,海马和下丘脑之间会形成一个特定的神经网络。无论是自然提取还是人工重新激活海马中的冷敏感记忆痕迹都能模拟在寒冷挑战期间观察到的生理反应。这些神经元群体对于寒冷记忆的提取是必要的。这些研究结果表明,欧博娱乐寒冷记忆的提取会引起全身的自主神经和行为反应,使小鼠能够维持体温稳态。
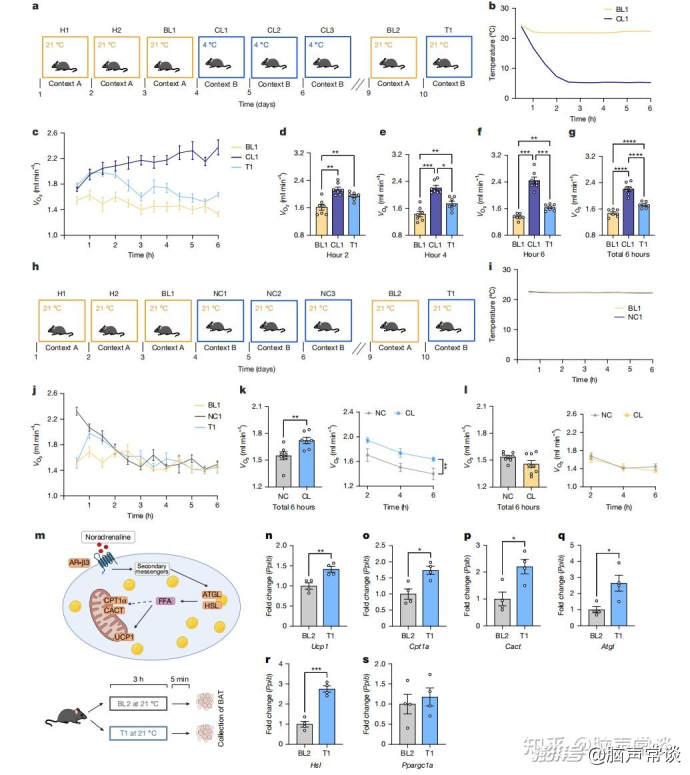
图一 情境性寒冷记忆提高代谢率和产热基因表达 小鼠在21°C(情境A)和4°C(情境B)环境下进行训练。通过测量氧气消耗、二氧化碳产量及活动量等指标来评估代谢率变化。在4°C环境中,小鼠的代谢率显著增加,表现为更高的氧气消耗、能量支出以及活动量。当小鼠被重新置于之前经历4°C寒冷挑战的情境B中时,即使实际环境温度为21°C,它们的代谢率仍然增加。这表明小鼠能够将特定环境与温度信息关联起来,这种现象是由情境线索而非新奇性引起的。排除了新奇性和一般性压力反应对代谢率的影响,例如暴露于捕食者气味并未导致代谢率增加。实验还证实了冷记忆的回忆而非长期寒冷暴露的效果或一般的压力反应引起了代谢率的增加。研究显示,在冷记忆召回期间,BAT中的多个产热基因(如UCP1、Cpt1a、Cact、Atgl和Hsl)也会上调。这些基因的上调有助于非颤抖性产热,是小鼠适应寒冷环境的关键机制之一。冷记忆不仅能够提高全身代谢率,欧博allbet还能引起回避行为。小鼠可以通过形成冷记忆来调控全身的体温调节反应,这些记忆使得它们能够在回忆起寒冷环境时调整自身的代谢率和行为以应对寒冷。总之,该研究揭示了小鼠可以基于冷记忆调整其生理反应,从而更好地适应不同的温度环境。
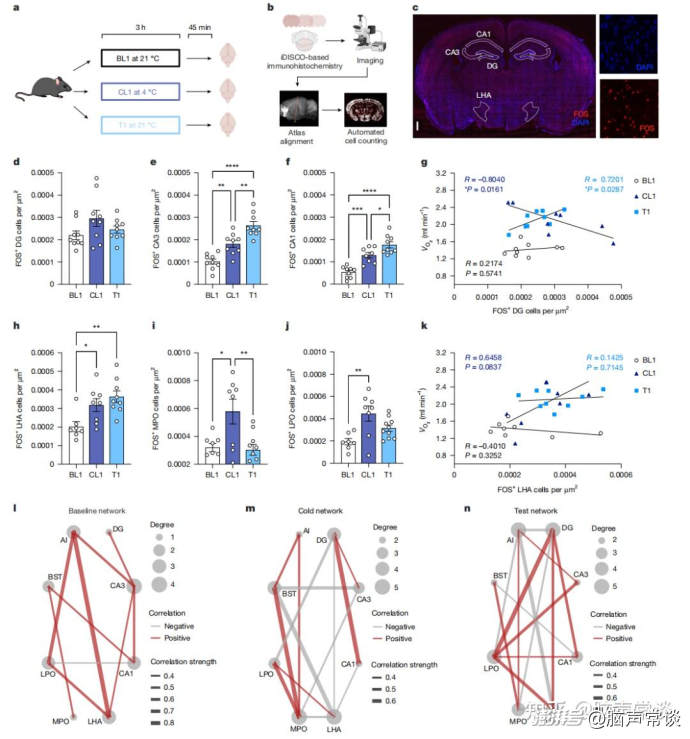
图二 情境性寒冷记忆在海马和下丘脑中被编码和提取 为了识别与寒冷记忆编码和提取相关的神经活动模式,检测了多个脑区的FOS表达。作者比较了BL1(基线第1天)、CL1(寒冷第1天)和T1(测试第1天)期间的FOS活性,以确定在特定条件下哪些区域处于活跃状态。为了实现对海马和下丘脑各区域的自动化FOS检测,所有大脑样本均通过一个自动化的全脑计数流程进行分析。结果显示,在三种条件下,齿状回(DG)中的FOS+细胞数量没有显著差异。然而,与BL1相比,在CL1和T1时,欧博百家乐CA3和CA1亚区中发现了冷激活的FOS活性,这表明CA3和CA1是参与寒冷反应的重要区域。尽管在三种条件下DG的FOS活性未发现先天性差异,但假设该区域在学习后可能通过与全身代谢的交互作用而发生变化。因此,将DG的FOS活性与BL1、CL1和T1时的氧气消耗进行了相关性分析。结果表明,在BL1时,DG的FOS活性与代谢率之间无相关性;在CL1时,氧气消耗与DG活性呈负相关;而在T1时,当寒冷记忆巩固后,二者之间出现了显著的正相关。类似的关联模式在CA1中也被观察到,但在CA3中未发现。海马的不同亚区参与了情境性寒冷记忆的编码或提取,且DG和CA1在T1时对调节全身代谢起到了一定作用。先前的研究已将外侧下丘脑区(LHA)、内侧视前区(MPO)和外侧视前区(LPO)确定为参与体温调节的关键脑区。因此,比较了这些区域在BL1、CL1和T1时的FOS活性。发现当小鼠在CL1暴露于寒冷环境时,LHA的FOS活性上调。当小鼠在T1回忆寒冷时,该区域也表现出相似的活性水平。虽然作者在寒冷暴露期间也观察到MPO和LPO的活性增加,但在T1时这些区域的FOS活性并未增加。此外,在其他被研究的下丘脑区域中,无论是CL1还是T1,均未发现FOS活性的增加。接下来,测试了LHA、MPO和LPO的活性是否与代谢率相关。发现只有在CL1暴露于寒冷的小鼠中,LHA的FOS活性与氧气消耗之间存在正相关趋势。这种趋势在任何其他条件或其他下丘脑区域中均未出现。这些发现表明,LHA在寒冷的编码和回忆过程中起重要作用,且其活性在寒冷经历期间与代谢率相关。最后对小鼠进行了恐惧条件反射实验,接受情境恐惧条件反射训练的小鼠在海马和下丘脑区域未表现出与寒冷实验中类似的FOS活性增加。此外,恐惧条件反射后,杏仁核区域的FOS活性增加,但在寒冷暴露或寒冷回忆期间未观察到类似现象。这些数据表明,海马和下丘脑中观察到的神经活动并非由压力引起。为了理解在寒冷暴露和寒冷记忆提取期间脑区之间的功能连接如何改变,进一步对不同脑区的FOS活性进行了相关性分析。发现与基线网络相比,当小鼠暴露于寒冷时,下丘脑区域之间的功能连接增强。此外,当小鼠回忆寒冷时,海马与下丘脑之间的功能连接比经历寒冷时更强,而这种现象在基线网络中未观察到。这些数据表明,从海马到下丘脑的功能连接是一种可塑性特征,是在小鼠编码寒冷情境记忆后形成的。
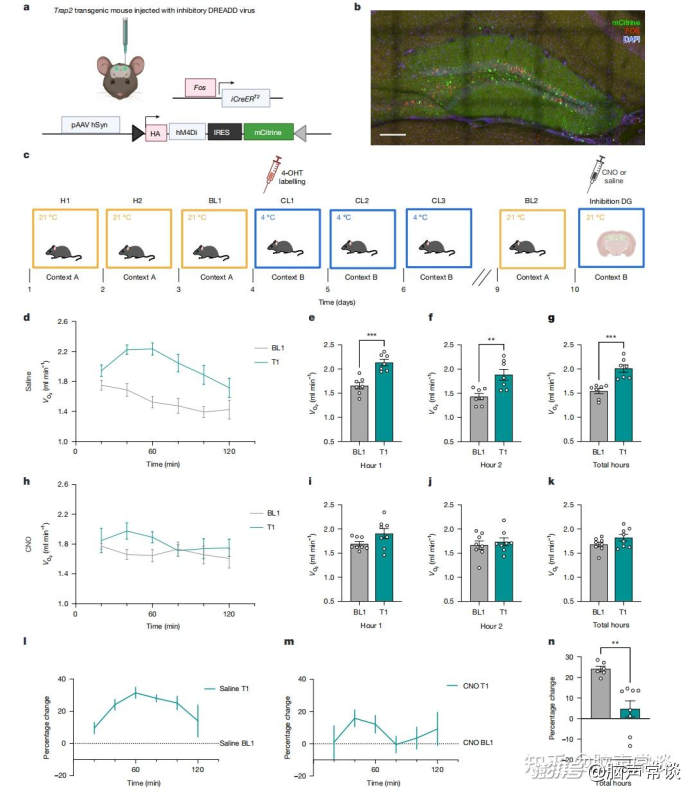
图三 抑制冷敏感记忆痕迹阻止了记忆对氧气消耗的影响 为了进一步探索冷敏感记忆痕迹细胞的作用,作者在寒冷记忆提取期间通过化学遗传学方法抑制了DG中的冷记忆痕迹细胞。为此,在CL1时用化学遗传学地抑制这些细胞,观察到在T1时向对照组小鼠注射生理盐水后,其代谢率相较于BL1有所增加,这种代谢率的增加在整个2小时测试期间以及总测试时间内均存在。相比之下,作者发现接受CNO处理的小鼠在T1时不再表现出学习到的代谢率增加。此外,发现在整个测试期间的任何时间点,条件性反应都消失了。当直接比较注射生理盐水和注射CNO的小鼠时,发现注射生理盐水的小鼠比注射CNO的小鼠表现出显著更高的代谢变化百分比。综上所述,通过抑制DG中的冷敏感细胞,可以抑制情境性寒冷记忆,从而阻止与这些情境刺激相关的条件性全身反应。 总结 作者的研究发现可能对代谢性疾病的潜在治疗途径具有重要的转化意义。在人类中,棕色脂肪组织与心脑血管代谢健康密切相关,这使其成为未来治疗的一个有前景的靶点。在本研究中,作者的目标是理解大脑如何影响基本的生理功能,并进一步识别治疗靶点,从而为未来心脑血管代谢疾病的精准治疗提供方向。 (责任编辑:) |